索元生物启动Pre-IPO融资,4大首创新药有望助力资本之路!
药明康德快讯:中国精准医疗企业- 索元生物近日宣布启动Pre-IPO融资,以支持其计划即将开展的enzastaurin用于治疗初发脑胶质母细胞瘤(GBM)的国际多中心 2b期的临床研究。
索元生物称,启动Pre-IPO融资以来,反响火热,预计不久将达到募资目标,公司计划于年底完成股改并作为创新型公司启动A股上市准备工作。
索元生物上轮融资为两年前的B轮融资,由久友资本、仙瞳资本、分享资本、浙商产融、越秀资本、乾瞻资本和闻方科技共同参与完成了3亿元融资。自该轮融资完成至今,索元生物已取得一系列重大进展。
本次被投资人非常看好的是索元生物已开发至临床后期的四款创新药DB102、DB103、DB104 和 DB105,它们均为一类全球首创(first-in-class)药物。四款创新药如四把猛火,将在全球产生巨大的社会效益,同时是该公司在融资行程中的强大推力。
DB102(enzastaurin),是一款小分子丝氨酸/苏氨酸激酶抑制剂,原为礼来(Eli Lilly and Company)开发,其作用机理在于作用于PKCβ、PI3K和AKT等肿瘤领域的关键靶点上,具有诱导肿瘤细胞死亡和阻碍肿瘤细胞增生的直接作用,以及抑制肿瘤诱导的血管生成的间接作用。该药用于一线治疗初治高危弥漫性大 B 细胞淋巴瘤(DLBCL)的国际临床3期试验正在中国和美国开展,目前已超完成70%的病例入组。该药物的第2个适应症——治疗初发脑胶质母细胞瘤(GBM)的国际多中心2b期临床试验的IND不久前获得美国FDA批准, 正启动试验的准备阶段。
DB103(pomaglumetad methionil),是一款开发用于治疗精神分裂症的药物,是索元生物从礼来公司引进,靶点是谷氨酸受体。该药物的国际多中心临床试验已于2018年底获得中国国家药监局的批准,目前已顺利启动1b期临床试验,有望成为该领域的重磅品种。
DB104(liafensine),是从 ARMI/百时美施贵宝(BMS) 获得的抗抑郁症药物。
DB105,是一款具有选择性、强效、全新的拮抗剂,靶标为α-2C肾上腺素受体(AR),开发用于治疗阿尔茨海默病。该药物原由芬兰奥立安集团开发,目前索元生物拥有该药的全球权益。
索元生物创立于2012年,是一家新型的、以快速有效的模式开发一类新药的精准医疗企业。该公司独特的模式在于,从国际大药厂引进经过临床后期试验证明其安全性且显示对部分患者有效的新药,并利用其独创的生物标记物平台技术在残余的临床样本中找到可预测药物疗效的生物标记物。通过这些新发现的生物标记物作为伴随诊断来筛选患者,索元生物能够在敏感患者中重新开展临床试验,从而优化疗效、安全性和耐受性,提高新药开发的成功率,从而达到以较低的成本、较短的时间开发创新药的目的。

在接受药明康德等媒体专访中,索元生物创始人、董事长罗文博士(上图)表示:“我们期待其中的 enzastaurin(DB102)能成为中国业界重磅的 ‘first-in-class’ 治疗药进入市场,公司争取在未来两年内完成3期临床研究。
衷心期待索元生物的融资之旅一切顺利,并在资本市场的助力下,早日将原创新药带给中国、乃至全球的患者。
另据医药观澜消息:
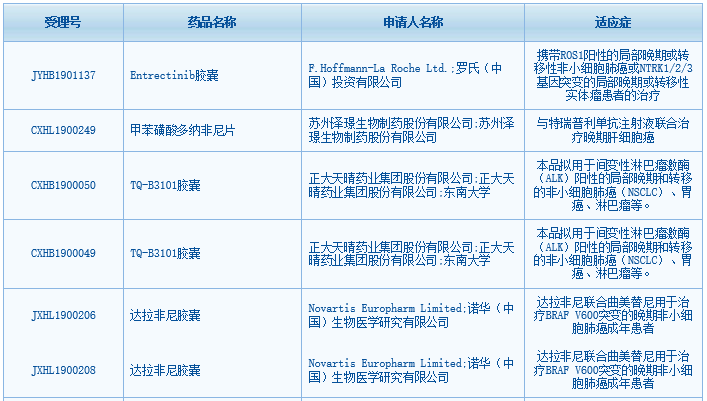
4款抗癌新药获批临床,来自罗氏、诺华、正大天晴和泽璟生物。
根据中国国家药监局药品审评中心(CDE)最新公示,又有多款药物获得临床试验默示许可,其中包括:
- 罗氏(Roche)的重磅“不限癌种”疗法entrectinib胶囊,拟开发用于携带ROS1阳性的局部晚期或转移性非小细胞肺癌或NTRK1/2/3基因突变的局部晚期或转移性实体瘤患者的治疗。
- 诺华(Novartis)的BRAF抑制剂达拉非尼胶囊,联合曲美替尼用于治疗BRAF V600突变的晚期非小细胞肺癌成年患者。
- 正大天晴的1.1类在研新药TQ-B3101胶囊,拟用于间变性淋巴瘤激酶(ALK)阳性的局部晚期和转移的非小细胞肺癌(NSCLC)、胃癌、淋巴瘤等。
- 泽璟生物的多激酶抑制剂甲苯磺酸多纳非尼片,与特瑞普利单抗注射液联合治疗晚期肝细胞癌。

▲图片来源:CDE官网
1.罗氏重磅新药:Entrectinib胶囊
Entrectinib是一款针对NTRK和ROS1基因融合而设计的特异性酪氨酸激酶抑制剂,它能够抑制TRK A/B/C和ROS1激酶活性。今年6月,罗氏公司宣布其“不限癌种”个体化药物entrectinib获得日本厚生劳动省(MHLW)批准,治疗携带NTRK基因融合的晚期复发实体瘤患者。这是entrectinib在全球范围内首次获批。继去年Loxo Oncology公司和拜耳(Bayer)联合开发的Vitrakvi(larotrectinib)获得FDA批准上市之后,这是第二款靶向NTRK基因融合的精准疗法获得批准上市。 据悉,该获批基于多项国际开放性试验数据。数据显示:entrectinib对10多种不同类型的NTRK融合阳性实体瘤患者均有治疗效果,超过一半的患者肿瘤缩小,总缓解率达到56.9%,中位缓解持续时间为10.4个月。
目前,该药的新药申请被FDA授予优先审评资格,用于治疗NTRK融合阳性的晚期或转移性实体瘤患者,以及ROS1融合阳性NSCLC患者。此次该药在中国获批临床,拟开发用于携带ROS1阳性的局部晚期或转移性非小细胞肺癌或NTRK1/2/3基因突变的局部晚期或转移性实体瘤患者的治疗。
2.诺华的BRAF抑制剂达拉非尼胶囊
达拉非尼(dabrafenib)是一款BRAF抑制剂药物。该药不能用于野生型黑色素瘤,使用前需检测BRAF V600E突变。BRAF是一种原癌基因,大约8%的人类肿瘤发生BRAF突变,且绝大部分突变形式为BRAF V600E突变,主要发生于黑色素瘤、甲状腺癌和结肠癌等肿瘤中。该突变导致下游MEK/ERK信号通路持续激活,对肿瘤的生长增殖和侵袭转移至关重要。达拉非尼由葛兰素史克(GSK)研发,2013年,FDA批准了其用于治疗转移性黑色素瘤和不能行手术治疗的黑色素瘤病人。2014年之后,在GSK与诺华的业务互换中,诺华以145亿美元收购了GSK的抗肿瘤产品,达拉非尼就是其中之一。之后几年,该药又收获了多项适应症的获批:2017年6月,FDA批准达拉非尼与曲美替尼联合治疗BRAF V600E突变的转移性非小细胞肺癌。2018年该药物再次获批两个适应症,分别为BRAF V600E突变阳性的晚期甲状腺未分化癌患者,以及BRAF V600E突变的3期黑色素瘤患者手术切除后的辅助治疗。
今年1月,中国国家药监局药品审评中心(CDE)受理了达拉非尼的上市申请,随后该药被纳入优先审评程序。目前,该产品的办理状态为“在审评审批中”。此次,该药获得临床默示许可,拟开发适应症为联合曲美替尼用于治疗BRAF V600突变的晚期非小细胞肺癌成年患者。
3.正大天晴的TQ-B3101胶囊
TQ-B3101胶囊是由正大天晴研制申报的一款小分子靶向抑制剂,注册分类为原化药1.1类。查询根据中国药物临床试验登记与信息公示平台可知,一项评价TQ-B3101胶囊治疗ROS1阳性非小细胞肺癌受试者疗效和安全性的2期单臂、多中心临床研究正在招募患者。
此次该产品获得临床试验许可,拟用于间变性淋巴瘤激酶(ALK)阳性的局部晚期和转移的非小细胞肺癌(NSCLC)、胃癌、淋巴瘤等。这意味着,TQ-B3101胶囊将被开发用于更多癌症种类。
4.泽璟生物的甲苯磺酸多纳非尼片
多纳非尼是泽璟生物自主研发的1类化学新药,是一款多激酶抑制剂。根据公开信息,该抑制剂既可抑制VEGFR、PDGFR等多种受体酪氨酸激酶的活性,也可直接抑制各种Raf激酶,并抑制下游的丝氨酸-苏氨酸激酶信号传导通路,具有抑制肿瘤细胞增殖和肿瘤血管的形成,发挥双重抑制、多靶点阻断的抗肿瘤作用。
目前该在研药物正开展3期临床,其中一项晚期肝癌2期临床试验共入组106例晚期不可手术的肝细胞癌患者,经独立影像学评估16周疾病控制率为42.5%,且总体安全性良好。此次该药物获得临床默示许可的适应症为:与特瑞普利单抗注射液联合治疗晚期肝细胞癌。其中,特瑞普利单抗注射液是由君实生物研发的PD-1单抗新药,已在中国获批上市。
(美国华文网 圣地亚哥华文网编发 药明康德文/图 USChinesePress.com SanDiegoChinesePress.com)
