据中国媒体报道,3月17日22时30分,2.12万盒进口新冠病毒治疗药物“奈玛特韦/利托那韦片”(Paxlovid),经上海外高桥保税区海关验放后,办结全部进口通关手续,火速运往全国抗疫一线。这是该种药物被纳入最新版新冠肺炎诊疗方案后全国的首批进口。
2022年2月11日,中国药监局根据《药品管理法》相关规定,按照药品特别审批程序,进行应急审评审批,附条件批准辉瑞公司新冠病毒治疗药物奈玛特韦片/利托那韦片组合包装(Paxlovid)进口注册。3月15日,国家卫生健康委发布的《新型冠状病毒肺炎诊疗方案(试行第九版)》修订要点显示,国家药监局批准的奈玛特韦片/利托那韦片(Paxlovid)特异性抗新冠病毒药物被写入诊疗方案。
上海海关综合处副处长胡晓明称,这批货物是从浦东机场口岸入境的。他们提前对接企业了解货物进口情况,制定并启动全程通关保障预案,指导企业采取“提前申报”模式。货物抵达浦东机场后,立即提离并转运至外高桥保税区,为企业后续的申报进口和分拨出运提供了宝贵的时间“提前量”。
保税区海关“接棒”后,在业务现场设置绿色通道,确保货物安全便捷通关。鉴于这批药物对储存环境有较为严格的要求,在接到企业的预约查验申请后,保税区海关指派关员在做好安全防护的前提下,赴企业开展入库查验工作,根据查验指令完成现场验核,实现通关“零等待”。
保税区海关综合业务二科科长耿静告诉记者:“这批货物数量比较大,我们充分发挥海关特殊监管区域物流分拨中心的功能,帮助企业根据实际情况和需求,合理安排分批出区及相应的运输计划,提供全天候通关保障,不让药品有一秒钟的耽搁。”
【相关报道】
辉瑞新冠口服药获附条件批准进口,君实生物等多家国内药企在布局
新京报讯(记者 王卡拉)2月12日,国家药监局发布公告,按照药品特别审批程序,进行应急审评审批,于2月11日附条件批准辉瑞公司新冠病毒治疗药物奈玛特韦片/利托那韦片组合包装(即Paxlovid)进口注册。这距离Paxlovid在美国获紧急使用授权(EUA)不到两个月时间。
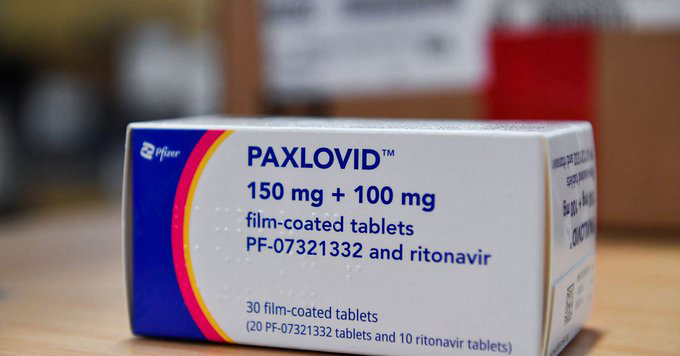
Paxlovid为口服小分子新冠病毒治疗药物,是由3CL蛋白酶抑制剂奈玛特韦片与利托那韦片组成的复方制剂,治疗时使用两片150mg的奈玛特韦片和一片100mg的利托那韦对新冠患者进行组合给药,每日两次,持续5天。
Paxlovid进口注册的适应症为用于治疗成人伴有进展为重症高风险因素的轻至中度新型冠状病毒肺炎患者,例如伴有高龄、慢性肾脏疾病、糖尿病、心血管疾病、慢性肺病等重症高风险因素的患者。国家药监局表示,患者应在医师指导下严格按说明书用药,使用中应高度关注说明书中列明的与其他药物相互作用信息。同时强调,上市许可持有人要继续开展相关研究工作,限期完成附条件的要求,及时提交后续研究结果。
2021年11月5日,辉瑞公布的Paxlovid的Ⅱ/Ⅲ期研究的中期分析结果显示,Paxlovid将住院或死亡风险降低了89%。2021年12月22日,美国食品药品监督管理局(FDA)授予Paxlovid紧急使用授权,成为首款获FDA授权的口服抗新冠病毒药物。今年1月辉瑞表示,Paxlovid在实验室体外试验中证实对奥密克戎新冠变异株有效。
截至目前,Paxlovid已在美国、英国、以色列、加拿大等全球多个国家/地区被批准上市或授权紧急使用。
辉瑞已经与国际组织药品专利池(MPP)签订许可协议,全球获得授权许可的合格仿制药企业将能够向95个中低收入国家/地区生产并供应Paxlovid,覆盖全球约53%的人口。辉瑞将不会对低收入国家的药物销售收取特许权使用费,并且将免除协议涵盖的所有国家药物销售的特许权使用费。
在口服抗新冠病毒药物研发上,国内也有多家药企在布局。今年1月14日,云顶新耀就曾宣布,将在全球开发和商业化新加坡实验药物研发中心的一组3CL蛋白酶抑制剂,该药有望成为同类领先的口服抗新冠病毒药物。除此之外,歌礼开发的ASC11及先声药业与上海药物研究所合作开发的SIM0417也都属于3CL蛋白酶抑制剂。
君实生物也已经与旺山旺水达成合作,共同承担口服核苷类抗新冠病毒候选药物VV116在全球范围内的临床开发和产业化工作。VV116由中国科学院上海药物研究所、中国科学院武汉病毒研究所、中国科学院新疆理化技术研究所、中国科学院中亚药物研发中心等共同研发。2021年12月31日,君实生物宣布,乌兹别克斯坦卫生部已批准VV116的紧急使用授权,公司评估该产品预计于今年下半年递交上市申请,国内上市申请正同步推进中。
