药明康德/报道:
对于华人学者在学术界做出的突破性研究,我们总是倍感亲切。今日,在顶尖学术期刊《自然》在线发表的多篇文章中,我们很高兴地看到,有4篇生物医药领域的研究来自于华人学者的课题组。在这篇文章里,我们也将为各位读者介绍这4篇论文。
1,Yueh-hsiu Chien课题组
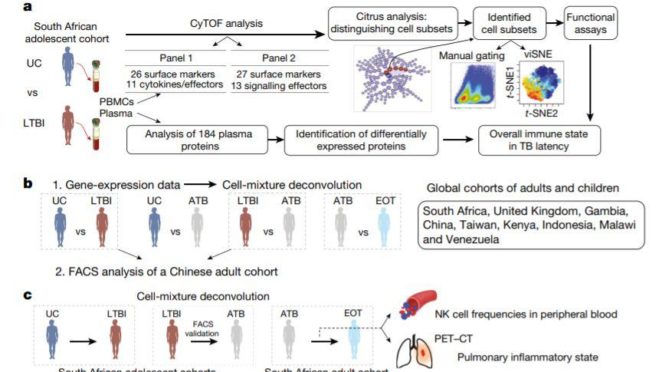
A multi-cohort study of the immune factors associated with M. tuberculosis infection outcomes
据估计,全世界有四分之一的人口可能有潜伏性结核感染。儘管其中不到10%会最终发病,但肺结核依然是全世界范围内,最为致命的传染病之一。不幸的是,我们对于这种疾病感染背后的免疫因素却知之甚少。在这项研究中,史丹福大学的Yueh-hsiu Chien教授联手Purvesh Khatri教授,做了一项大规模的研究与分析。他们发现,潜伏性结核感染与增强的细胞毒性反应有关,而持续的炎症会影响到T细胞与B细胞。另一方面,循环的自然杀手细胞数量也与疾病的进展有关,这些细胞的数量越多,疾病的活性就越低。综合来看,研究人员指出他们的发现为肺结核潜伏提供了重要的病理生理学洞见,寻找到了可能影响感染预后的关键因素。
相关论文:R Chowdhury et al., (2018) A multi-cohort study of the immune factors associated with M. tuberculosis infection outcomes, Nature, DOI: https://doi.org/10.1038/s41586-018-0439-x
2,管坤良课题组
RAP2 mediates mechanoresponses of the Hippo pathway
哺乳动物的细胞周围,往往是其他细胞,或是细胞外基质。它们不仅为细胞提供了结构上的支撑,还能影响到诸多生物学进程。其中,Hippo通路的效应蛋白YAP与TAZ就受到了相应的调节,会根据细胞外基质的刚性程度,介导细胞的反应。在这项研究中,来自加州大学圣地亚哥分校的管坤良教授课题组发现,RAP2蛋白是这条通路里的重要细胞内信号「传感器」。一旦敲除RAP2蛋白,YAP与TAZ就无法根据细胞外基质的刚性做出反应,会导致异常细胞生长。研究人员同样阐明了背后的生物学机制。原来,细胞外基质的刚性如果较低,就会激活RAP2,使它结合到MAP4K4、MAP4K6、MAP4K7、以及ARHGAP29蛋白上,进一步激活LATS1与LATS2,并抑制YAP与TAZ。这项重要的研究表明RAP2是一款「分子开关」,能参与机械信号的传感。这让我们对于相关信号通路的理解,又加深了一层。
相关论文:Z Meng et al., (2018) RAP2 mediates mechanoresponses of the Hippo pathway, Nature, DOI: https://doi.org/10.1038/s41586-018-0444-0
3,李伟、刘光慧、胡宝洋课题组
SIRT6 deficiency results in developmental retardation in cynomolgus monkeys
在啮齿类动物中,SIRT6是一款与长寿有关的蛋白。但它在灵长类动物里的生物学功能,却一直没有得到阐明。在本篇论文里,来自中科院旗下多个机构的李伟、刘光慧、胡宝洋课题组联合在食蟹猴模型中,利用基于CRISPR-Cas9的方法,实现了SIRT6的全敲除。研究表明,这些缺少SIRT6的猴子会在出生数小时后死亡,且有严重的发育迟缓现象。在神经系统里,SIRT6的缺失会激活非编码RNA H19(本身能抑制发育),从而延缓神经元的分化。这一发现在人类细胞模型中也得到了重複。进一步发现表明,SIRT6的缺乏会在H19的印记调控区域导致组蛋白的过度乙醯化,上调H19。这一发现表明SIRT6参与到了非人灵长类动物的发育中,对人类的围产期致死综合徵等疾病有望带来新的理解。
相关论文:W Zhang et al., (2018) SIRT6 deficiency results in developmental retardation in cynomolgus monkeys, Nature, DOI: https://doi.org/10.1038/s41586-018-0437-z
4,徐菲课题组
Crystal structure of the Frizzled 4 receptor in a ligand-free state
FZD是一类G蛋白偶联受体(GPCR),在Wnt信号通路中有重要的生理作用。作为这条通路里的关键蛋白之一,理解FZD的结构,对于基础研究,或是临床转化来说,都有极大的意义。在这项研究里,来自上海科技大学的徐菲课题组揭示了人类FZD4蛋白在没有配体的情况下,其跨膜区域的原子解析度结构。该结构表明,其VI号螺旋更短,也更紧实,与其他已报导的GPCR都不一样。这带来了一个极为狭窄和高度亲水的「口袋」,使传统的GPCR配体不适合与其结合。后续研究发现,这个「口袋」在所有的FZD蛋白中都保守存在,这从一定程度解释了为何之前难以开发针对FZD的配体。后续的研究又在VII号螺旋里找到了两个和FZD4激活相关的缠结。这些发现均表明,FZD蛋白在演化的道路上,发展出了全新的配体结合与激活机制。
相关论文:S Yang et al., (2018) Crystal structure of the Frizzled 4 receptor in a ligand-free state, Nature, DOI: https://doi.org/10.1038/s41586-018-0447-x
我们向这些带来重磅学术突破的科学家们再次表示祝贺!
历史上的“华人日”
本文学者照片除特别注明外,均来自相应科研院所官网,研究图片均来自《自然》。
本文来自药明康德微信团队,欢迎转发到朋友圈,谢绝转载到其他平台。如有开设白名单需求,请在文章底部留言。如有其他合作需求,请联繫wuxi_media@wuxiapptec.com。
癌症突破
抗癌疫苗 | 癌症地图 | KRAS | 酒精 | CAR-T 2.0 | 单细胞CAR-T |
| | | 血检 | | | |
| | | | | | | | | | |
原文网址:https://read01.com/O34g26z.html