药明康德/报道:诺和诺德(Novo Nordisk)公司昨日宣布,美国FDA批准了公司产品,口服索马鲁肽(oral semaglutide,商品名Rybelsus)上市,与饮食和锻炼相结合,改善2型糖尿病患者的血糖控制。每日口服一次的索马鲁肽药片是第一款获得FDA批准的口服胰高血糖素样肽-1受体激动剂(GLP-1RA)。它的出现打破了2型糖尿病患者每天或每周需要接受GLP-1RA注射的格局,为他们控制血糖提供了侵入性更小的便捷治疗选择。“能够用每日服用一次的小药片递送GLP-1这一生物制剂的疗效,是非常独特的成就,”诺和诺德公司的首席科学官Mads Krogsgaard Thomsen博士说:“它有点像一个圣杯(holy grail)。”今天,药明康德内容团队将与读者回顾诺和诺德摘得口服GLP-1RA“圣杯“的历程。
GLP-1,控制血糖的肠促胰岛素
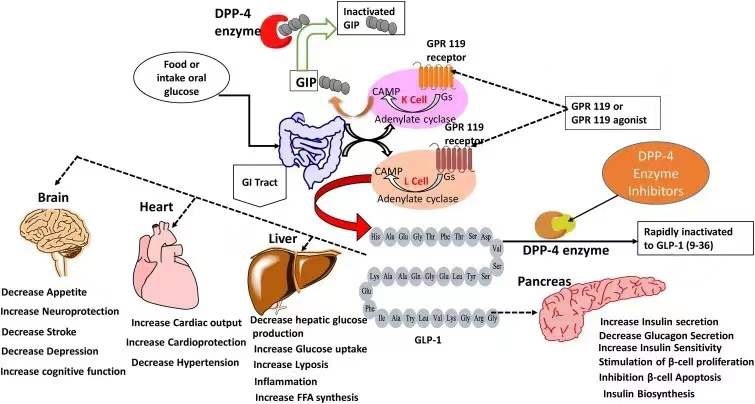
GLP-1是肠道细胞分泌的一种多肽类激素,它通过与GLP-1受体相结合,刺激胰岛素的分泌,并且抑制胰高血糖素的分泌,从而促进葡萄糖的新陈代谢。同时,它还能够能起到延缓胃排空和抑制食欲的后果。天然的GLP-1在人们用餐之后,受到葡萄糖的刺激而分泌。在2型糖尿病患者中,GLP-1的分泌水平显著下降,这也是导致患者血糖不受控制的重要原因之一。因此,开发GLP-1类似物一直是治疗2型糖尿病的重要研发方向。
然而,天然GLP-1的半衰期很短,它会迅速被二肽基肽酶-4(DDP4)降解和被肾脏排出,静脉注射GLP-1的半衰期只有1-2分钟。因此,如何延长GLP-1类似物的半衰期是GLP-1RA药物开发的第一个难关。
利拉鲁肽,首款对人类GLP-1进行改造的GLP-1RA
在延长GLP-1RA半衰期的道路上,研发人员采用了多种手段。一种策略是抑制DDP4的活性,从而间接提高GLP-1的水平。这一策略诞生了多款DDP4抑制剂,第一款DDP4抑制剂西他列汀(sitagliptin)在2006年获得FDA批准上市。
另一种延长GLP-1RA半衰期的策略是寻找GLP-1在其它动物中的类似物。这一策略带来了第一款GLP-1RA艾塞那肽(exenatide),它是基于一种蜥蜴毒素中的GLP-1类似物,与人类GLP-1有53%的同源性(homology)。艾塞那肽在2005年被FDA批准上市。然而,由于艾塞那肽氨基酸序列与人类GLP-1的差异,它可能导致人体的免疫系统产生特异性抗体。
诺和诺德公司的策略是通过对人类GLP-1的改造,提高它的半衰期。对艾塞那肽和GLP-1氨基酸顺序的比较发现,将GLP-1多肽中第8位的丙氨酸(Ala8)替换成其它的氨基酸可以让GLP-1抵抗DDP4的降解。由于Ala8同时在GLP-1与GLP-1受体的结合方面起到重要作用,在检验了多种氨基酸替换方式之后,研究人员发现将Ala8替换成α-氨基异丁酸,能够在保持GLP-1与受体结合亲和力的同时,抵抗DDP4的降解。这一技术后来在索马鲁肽中得到应用。
同时,研究人员用脂肪酸侧链对GLP-1进行了修饰,这一修饰促进了GLP-1与血液中白蛋白(albumin)的可逆性结合,不但保护它不被DDP4降解,而且延缓GLP-1在肾脏被过滤排出。对GLP-1的这一系列改造带来了利拉鲁肽(liraglutide),它在2010年被FDA批准上市,是一款每日注射一次的GLP-1受体激动剂,在血浆中的半衰期提高到13个小时。
索马鲁肽,从每日一次到每周一次注射
利拉鲁肽和艾塞那肽的成功吸引了人们对基于GLP-1疗法的关注,然而对有些2型糖尿病患者来说,每日接受注射仍然是阻碍他们用药的障碍。因此,业界的研发方向着重于如何进一步改善疗法的便捷性,寻找能够每周注射一次的GLP-1RA。
进一步延长GLP-1RA半衰期的策略包括将药物封装在可以被生物降解的缓释微球中(每周一次的艾塞那肽),将GLP-1多肽与抗体Fc片段(度拉糖肽)或白蛋白(阿必鲁肽)融合形成融合蛋白。
诺和诺德的策略是在利拉鲁肽的基础上,继续优化对GLP-1的脂肪酸侧链修饰。研究人员对脂肪酸侧链的长短、构成和连接脂肪酸侧链与GLP-1的接头都作出了改进,生成的索马鲁肽半衰期延长到了165个小时。它在2017年底获得FDA批准。成为每周注射一次的GLP-1RA。
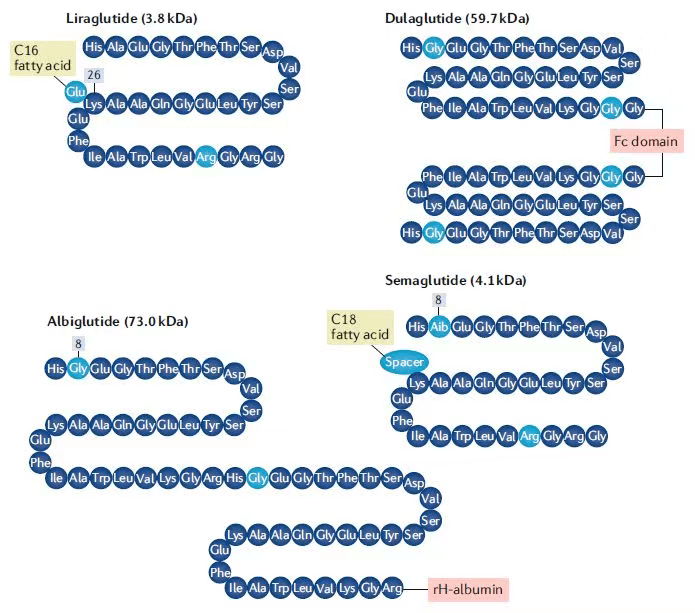
▲长效GLP-1受体激动剂结构比较(图片来源:参考资料[4])
十年磨一剑,摘得口服GLP-1受体激动剂的“圣杯“
过去15年里,GLP-1RA对2型糖尿病患者的治疗产生了深远的影响。由于GLP-1RA与胰岛素相比,具有更大的安全性窗口,因此让口服GLP-1RA成为可能。
口服药物从便捷角度上讲,是患者更为倾向使用的用药方式。但是,通常口服药物为小分子,而且需要具备一定的疏水性。对于GLP-1RA来说,一种方法是开发激活GLP-1受体的小分子激动剂。例如,礼来(Lilly)公司去年与罗氏旗下的Chugai Pharmaceutical公司达成协议,开发GLP-1受体非肽类激动剂OWL833。
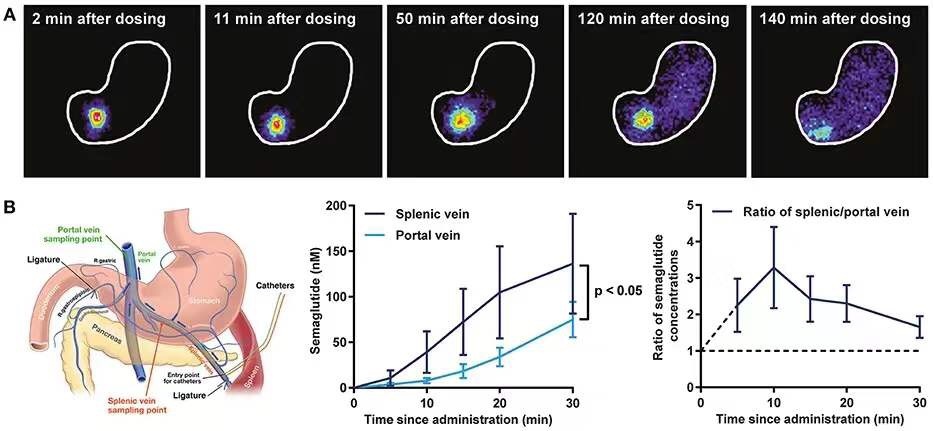
而另一种策略是使用吸收增强剂(absorption enhancer)。诺和诺德过去10年里一直在这个方向上摸索。口服索马鲁肽是将索马鲁肽与名为SNAC的小分子吸收增强剂一起构成的口服配方。通常,小分子药物的吸收主要在肠道进行。然而,多肽类药物在肠道吸收将面临很大的挑战,因为肠道中存在的多种肽酶会将多肽在被吸收之前就降解掉。
口服索马鲁肽的独特之处在于,SNAC与索马鲁肽的结合能够让索马鲁肽在胃部被吸收。同时SNAC在胃部的溶解能够在局部提高环境的pH值,这不但能够提高索马鲁肽的溶解度,而且防止索马鲁肽被胃中的肽酶降解,因为在胃中的肽酶需要酸性环境才能够起作用,在中性pH环境下几乎没有活性。
实验表明,SNAC由于它的亲脂性,能够嵌入到细胞膜上,帮助索马鲁肽和SNAC被细胞快速吸收。这一配方让索马鲁肽达到足够的口服生物利用度。虽然是口服剂型,口服索马鲁肽在控制血糖和降低患者体重方面的表现也不逊于注射剂型的索马鲁肽。FDA的批准是基于口服索马鲁肽在多项PIONEER临床试验中表现出的疗效和安全性。这些临床试验总共包括9543名2型糖尿病成人患者。在PIONEER临床试验中,口服索马鲁肽与对照组相比,更好地降低患者的糖化血红蛋白水平(HbA1c)和体重,对照组包括西他列汀、利拉鲁肽、恩格列净和安慰剂。
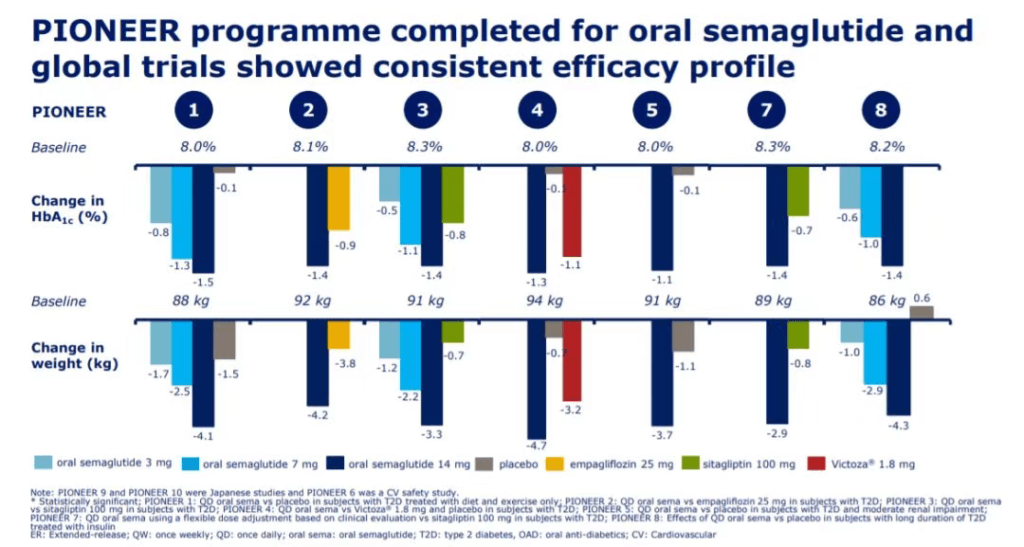 ▲口服索马鲁肽在降低糖化血红蛋白水平和体重方面表现优异(图片来源:参考资料[5])
▲口服索马鲁肽在降低糖化血红蛋白水平和体重方面表现优异(图片来源:参考资料[5])
从第一款GLP-1RA药物获得FDA批准到今天口服索马鲁肽获批,GLP-1RA已经经过了数次迭代,随着药物研发的不断进步,为2型糖尿病患者带来了更有效、更便捷的治疗手段。2型糖尿病仍然是威胁全球人口健康的重大挑战,我们期待医药生态圈成员的共同努力,能够为广大患者带来更多更好的疗法。
参考资料:
[1] FDA approves first oral GLP-1 treatment for type 2 diabetes. Retrieved September 19, 2019, from https://www.fda.gov/news-events/press-announcements/fda-approves-first-oral-glp-1-treatment-type-2-diabetes
[2] Sharma et al., (2018). Recent updates on GLP-1 agonists: Current advancements & challenges. Biomedicine & Pharmacotherapy, https://doi.org/10.1016/j.biopha.2018.08.088
[3] Knudsen and Lau. (2019). The Discovery and Development of Liraglutide and Semaglutide. Front. Endocrinol., https://doi.org/10.3389/fendo.2019.00155.
[4] Andersen et al., (2018). Glucagon-like peptide 1 in health and disease. Nature Reviews Endocrinology, https://doi.org/10.1038/s41574-018-0016-2
[5] Novo Nordisk Investor Presentation, First Quarter of 2019. Retrieved September 20, 2019, from https://www.novonordisk.com/content/dam/Denmark/HQ/investors/irmaterial/investor_presentations/2019/20190503_Q1%202019%20roadshow%20presentation.pdf
[6] Rybelsus® (semaglutide tablets), the first GLP-1 in a tablet approved in the US. Retrieved September 20, 2019, from https://www.novonordisk.com/content/Denmark/HQ/www-novonordisk-com/en_gb/home/media/news-details.2172050.html