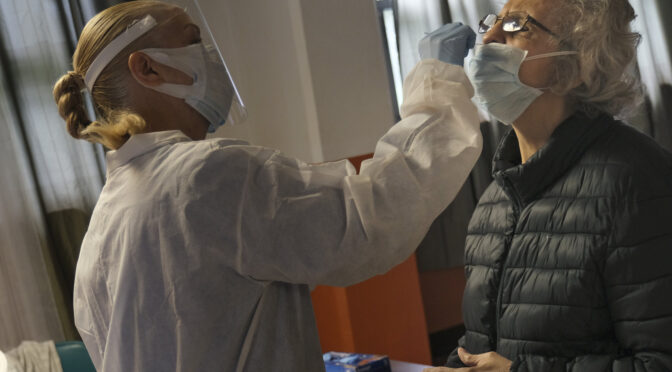
美国食品药品监督管理局(FDA)周六宣布,已首次紧急批准圣地亚哥魁德公司(Quidel)一种检测冠状病毒的新型方法,称为抗原检测。
该测试通过用鼻拭子采集样本寻找与病毒相关的蛋白质碎片。FDA在一份声明中说,它可以在几分钟内产生结果。该机构指出,与已经批准的基因检测相比,抗原检测更便宜、更容易使用,一旦多家制造商进入市场,可能“潜在规模达到每天检测数百万美国人”。
到目前为止,只有总部位于圣地亚哥的魁德尔公司获得了测试授权。这项授权是星期五晚些时候授予的。
另外两种针对冠状病毒的检测已经得到紧急授权。其中一种称为聚合酶链式反应(PCR)检测,是一种分子诊断工具,可以识别病毒的遗传物质。另一种是抗体测试。
抗原检测并非无缺点。FDA指出,在排除患者感染方面,检测的可靠性较低,阴性结果“可能需要在作出治疗决定之前通过PCR检测进行确认,或者防止由于假阴性而可能传播病毒”.
Quidel 在圣地亚哥三处的机构
该机构说:“抗原检测对病毒非常特异,不如PCR分子检测敏感。”这意味着抗原检测的阳性结果是高度准确的,但假阴性的几率更高,因此阴性结果不排除感染。”
FDA说希望更多的抗原检测得到批准,并且它“将在对抗COVID-19的斗争中发挥关键作用”。
(美国华文网 圣地亚哥华文网伊隽编发 USChinesePress.com SanDiegoChinesePress.com)