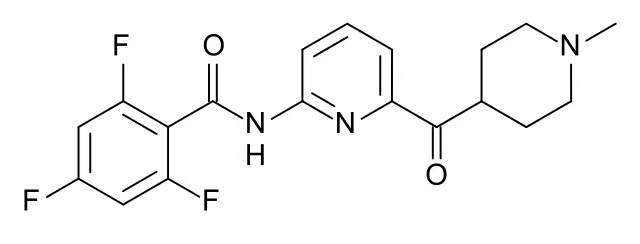药明康德报道:20年来急性治疗偏头痛首个重大创新。礼来(Lilly)公司宣布,美国FDA批准该公司开发的Reyvow(lasmiditan)片剂上市。作为急性疗法治疗有先兆或无先兆成年偏头痛患者。
Reyvow具有独特的作用机制,是FDA批准的首款也是唯一款血清素(5-HT)1F受体激动剂。新闻稿指出,这是20多年来,FDA批准急性治疗偏头痛的第一种新药物类型。
偏头痛是一种以严重头痛发作为特征的神经疾病,伴随头痛的其它症状包括恶心和对声光敏感。超过10%的世界人口受到偏头痛的困扰,而妇女受到偏头痛影响的几率是男性的三倍。虽然目前有多种治疗和预防偏头痛的药物,但是它仍然没有得到足够的重视和治疗。据统计,近40%的偏头痛患者在接受第一种急性疗法治疗的时候反应不足。
礼来公司开发的Reyvow是一种创新口服5-HT1F受体激动剂。它能够与5-HT1F受体以高亲和力相结合。Reyvow(lasmiditan)是获得FDA批准的首款“地坦”(ditans)类药物。目前常见的偏头痛急性疗法为曲坦类(triptans)药物,这些药物是5-HT1B/1D受体激动剂,虽然它们在缓解偏头痛方面有着显著的疗效,然而激活5-HT1B受体亚型能够产生血管收缩效应,带来其它副作用。Reyvow不会激活5-HT1B受体,因此不会产生血管收缩效应。对于患有心血管疾病或处于心血管疾病风险中的偏头痛患者来说更为安全。
▲Lasmiditan分子结构式(图片来源:Anypodetos [Public domain])
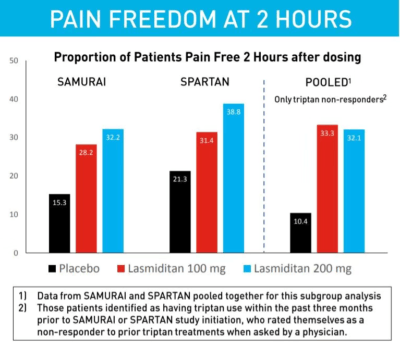
Reyvow的疗效在两项随机双盲,含安慰剂对照的3期临床试验(SAMURAI和SPARTAN)中得到验证。3177名有偏头痛历史的患者参加了这两项临床试验。试验结果表明,Reyvow组与安慰剂组相比,在服药2个小时后患者头痛完全消失的比例显著提高,Reyvow同时显著消除其它最困扰患者的偏头痛症状(恶心和声光敏感)。值得一提的是,在对曲坦类药物反应不足的患者亚群中,Reyvow也能够产生良好的效果。
▲Reyvow在3期临床试验中的部分疗效结果(图片来源:参考资料[3])
“上百万偏头痛患者每天要与无法消除的疼痛和其它偏头痛症状作斗争。在偏头痛急性治疗方面仍然存在很大未竟需求。今天的批准让我们感到非常自豪,礼来将继续为偏头痛患者造福,”礼来生物医药神经科开发副总裁Gudarz Davar博士说:“在治疗偏头痛方面我们有了新的期望值,无痛是偏头痛患者和医师们的治疗目标。礼来将继续开发创新产品,为偏头痛患者提供新的治疗选择。”
参考资料:
[1] FDA approves new treatment for patients with migraine. Retrieved October 11, 2019, from https://www.prnewswire.com/news-releases/fda-approves-new-treatment-for-patients-with-migraine-300937273.html
[2] Lilly’s REYVOW™ (lasmiditan), The First and Only Medicine in a New Class of Acute Treatment for Migraine, Receives FDA Approval. Retrieved October 11, 2019, from https://www.prnewswire.com/news-releases/lillys-reyvow-lasmiditan-the-first-and-only-medicine-in-a-new-class-of-acute-treatment-for-migraine-receives-fda-approval-300937322.html
[3] 2018 Investment Community Meeting. Retrieved October 11, 2019, from https://investor.lilly.com/static-files/e1cc74de-ada5-4ae4-b5a4-7ecf0969197d
[4] Lilly Submits New Drug Application to the FDA for Lasmiditan for Acute Treatment of Migraine, Receives Breakthrough Therapy Designation for Emgality™ (galcanezumab-gnlm) for Prevention of Episodic Cluster Headache. Retrieved October 11, 2019, from https://investor.lilly.com/news-releases/news-release-details/lilly-submits-new-drug-application-fda-lasmiditan-acute
[5] Therapeutic novelties in migraine: new drugs, new hope? Retrieved October 11, 2019, from https://doi.org/10.1186/s10194-019-0974-3